新聞資訊 了解首宏動態、掌握行業資訊
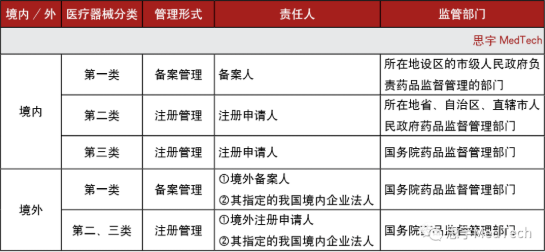
01 醫療器械分類管理方式及監管部門
02 第一類醫療器械備案流程及材料要求
(一)第一類醫療器械備案流程與時限
(二)第一類醫療器械備案申請材料
1.第一類醫療器械備案表
2.關聯文件
(1)境內備案人提供:企業營業執照副本或事業單位法人證書的復印件。
委托其他企業生產的,應當提供受托企業資格文件(營業執照副本復印件)、委托合同和質量協議。
(2)境外備案人提供:
①境外備案人企業資格證明文件:境外備案人注冊地所在國家(地區)公司登記主管部門或醫療器械主管部門出具的能夠證明境外備案人存續且具備相應醫療器械生產資格的證明文件;或醫療器械對外貿易機構為境外備案人出具的能夠證明境外備案人具備相應醫療器械生產資格的證明文件。
②境外備案人注冊地或生產地址所在國家(地區)醫療器械主管部門出具的準許該產品上市銷售的證明文件。備案人注冊地或生產地址所在國家(地區)未將該產品作為醫療器械管理的,備案人需提供相關文件,包括備案人注冊地或者生產地所在國家(地區)準許該產品上市銷售的證明文件。未在境外備案人注冊地或生產地所在國家(地區)上市的創新醫療器械可以不提交。
③醫療器械進口備案人在中國境內指定代理人的委托書、代理人承諾書,代理人營業執照副本復印件。
3.產品技術要求
4.產品檢驗報告
5.產品說明書及最小銷售單元標簽設計樣稿
6.生產制造信息
7.符合性聲明
8.其他資料(必要時)
03 第二類醫療器械注冊流程及材料要求
(一)第二類醫療器械注冊流程及時限
(二)第二類醫療器械注冊申請材料
1.境內醫療器械注冊申請表
2.資格證明
3.產品技術要求
4.安全風險分析報告
5.適用的產品標準及說明
6.產品性能自測報告
7.醫療器械檢測機構出具的產品注冊檢測報告
8.醫療器械臨床試驗資料(如需)
9.醫療器械說明書
10.產品生產質量體系考核(認證)的有效證明文件
11.申請人應當對其所提交材料真實性的自我保證聲明
12.申請人不是法定代表人或負責人本人,企業應當提交《授權委托書》2份
04 第三類醫療器械注冊流程及材料要求
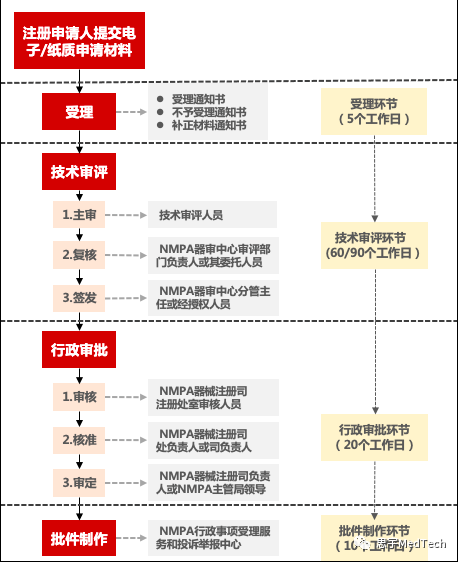
(一)注冊流程與時限
(二)第三類醫療器械注冊申請材料
1.醫療器械注冊申請表
2.醫療器械生產企業資格證明
3.產品技術報告(應加蓋生產企業公章)
4.安全風險分析報告(應加蓋生產企業公章)
5.適用的產品標準及說明:
6.產品性能自測報告
7.醫療器械檢測機構出具的產品注冊檢測報告
8.醫療器械臨床試驗資料
9.醫療器械說明書:
10.產品生產質量體系考核(認證)的有效證明文件
11.所提交材料真實性的自我保證聲明
12.申請資料(重點是臨床試驗報告)和樣品生產過程的真實性核查報告。
免責聲明:帶有本公司標識的圖片未經授權轉載,將追究法律責任;文章部分文字、圖片,視頻來源于網絡,如有侵權,請聯系刪除,版權歸原作者所有。

首宏醫療控股集團股份有限公司 地址:山東省青島市南區南京路8號府都大廈 16、20-22 層 聯系電話:400-699-8388
Copyright @ 2018 Safehigh ALL Right Reserved.
ICP備案:魯ICP備19047490號-1